Содержание
Перманганатная обработка DNAPL в реактивных барьерах и схемах затопления зоны источника — Заключительный отчет (Технический отчет)
Перманганатная обработка DNAPL в реактивных барьерах и схемах затопления зоны источника — Заключительный отчет (Технический отчет) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другое связанное исследование
Это исследование обеспечивает подробное понимание окислительного разрушения органических загрязнителей на уровне процесса с акцентом на пути реакции и кинетику. Заметное увеличение скорости потребления MnO {sup {minus}} со смесями ТХУ и ПХЭ доказывает, что межфазные катализаторы обладают способностью повышать скорость окисления ДНКФЛ как в чистой фазе, так и в смесях, и что существует значительный потенциал для тестирования катализируемых схема в полевых условиях. Во-вторых, в качестве попытки усилить окисление ДНКФЛ мы пытаемся использовать эффекты сорастворимости, используя различные смеси спирта и воды для повышения растворимости ДНКФЛ. Предварительные результаты экспериментов по сорастворимости указывают на усиление переноса ТХЭ неводной фазы в раствор ТБА-вода и скорость разложения ТХЭ в водной фазе.
Во-вторых, в качестве попытки усилить окисление ДНКФЛ мы пытаемся использовать эффекты сорастворимости, используя различные смеси спирта и воды для повышения растворимости ДНКФЛ. Предварительные результаты экспериментов по сорастворимости указывают на усиление переноса ТХЭ неводной фазы в раствор ТБА-вода и скорость разложения ТХЭ в водной фазе.
- Авторов:
Шварц, Ф.В.
- Дата публикации:
- Исследовательская организация:
- Университет штата Огайо, Колумбус, Огайо (США)
- Организация-спонсор:
- Управление экологического менеджмента Министерства энергетики США (EM) (США)
- Идентификатор ОСТИ:
- 775438
- Номер(а) отчета:
- МЭ/ER/14735; № проекта 54585
№ проекта 54585; РНН: Ah300129%%222
- Номер контракта с Министерством энергетики:
- ФГ07-96ЭР14735
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: PBD: 1 октября 2000 г.

- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 54 НАУКИ ОБ ОКРУЖАЮЩЕЙ СРЕДЕ; КАТАЛИЗАТОРЫ; НОРМЫ ПОТРЕБЛЕНИЯ; КИНЕТИКА; СМЕСИ; ОКИСЛЕНИЕ; ПЕРМАНГАНАТЫ; ТЕСТИРОВАНИЕ; РЕАКТИВНЫЕ БАРЬЕРЫ; ПЕРМАНГАНАТ; ОКИСЛИТЕЛЬНАЯ ДЕСТРУКЦИЯ; ДНКПЛ; НАПЛ; ТСА; ТВК; ПКЭ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Schwartz, F W. Перманганатная обработка DNAPL в реакционноспособных барьерах и схемах затопления зон источников - Заключительный отчет . США: Н. П., 2000.
Веб. дои: 10.2172/775438.
Копировать в буфер обмена
Schwartz, F W. Перманганатная обработка DNAPL в реакционноспособных барьерах и схемах затопления зон источников - Заключительный отчет . Соединенные Штаты. https://doi.org/10.2172/775438
Перманганатная обработка DNAPL в реакционноспособных барьерах и схемах затопления зон источников - Заключительный отчет . Соединенные Штаты. https://doi.org/10.2172/775438
Копировать в буфер обмена
Шварц, Ф. В. 2000.
«Обработка перманганатом DNAPL в реактивных барьерах и схемах затопления зоны источника - Заключительный отчет». Соединенные Штаты. https://doi.org/10.2172/775438. https://www.osti.gov/servlets/purl/775438.
Копировать в буфер обмена
@статья{osti_775438,
title = {Обработка перманганатом ДНАПЛ в реактивных барьерах и схемах затопления зоны источника - окончательный отчет},
автор = {Шварц, Ф.В.},
abstractNote = {Это исследование обеспечивает подробное понимание окислительного разрушения органического загрязнителя на уровне процесса с акцентом на пути реакции и кинетику. Заметное увеличение скорости потребления MnO {sup {minus}} со смесями ТХУ и ПХЭ доказывает, что межфазные катализаторы обладают способностью повышать скорость окисления ДНКФЛ как в чистой фазе, так и в смесях, и что существует значительный потенциал для тестирования катализируемых схема в полевых условиях. Во-вторых, в качестве попытки усилить окисление ДНКФЛ мы пытаемся использовать эффекты сорастворимости, используя различные смеси спирта и воды для повышения растворимости ДНКФЛ. Предварительные результаты экспериментов по сорастворимости указывают на усиление переноса ТХЭ неводной фазы в раствор ТБА-вода и скорость разложения ТХЭ в водной фазе.},
Заметное увеличение скорости потребления MnO {sup {minus}} со смесями ТХУ и ПХЭ доказывает, что межфазные катализаторы обладают способностью повышать скорость окисления ДНКФЛ как в чистой фазе, так и в смесях, и что существует значительный потенциал для тестирования катализируемых схема в полевых условиях. Во-вторых, в качестве попытки усилить окисление ДНКФЛ мы пытаемся использовать эффекты сорастворимости, используя различные смеси спирта и воды для повышения растворимости ДНКФЛ. Предварительные результаты экспериментов по сорастворимости указывают на усиление переноса ТХЭ неводной фазы в раствор ТБА-вода и скорость разложения ТХЭ в водной фазе.},
дои = {10,2172/775438},
URL = {https://www.osti.gov/biblio/775438},
журнал = {},
номер =,
объем = ,
место = {США},
год = {2000},
месяц = {10}
}
Копировать в буфер обмена
Посмотреть технический отчет (1,70 МБ)
https://doi. org/10.2172/775438
org/10.2172/775438
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Трехмерная параллельная наноскопия RESOLFT для объемной визуализации живых клеток
Новые результаты
Andreas Bodén, Francesca Pennacchietti, View ORCID ProfileIlaria Testa
doi: https://doi.org/10.1101/2020.01.09.898510
- Abstract
- Full Text
- Info/History
- Metrics
- Supplementary material
- Preview PDF
Abstract
Объемную архитектуру органелл и молекул внутри клеток можно исследовать только с помощью микроскопов, обладающих достаточно высокой разрешающей способностью во всех трех пространственных измерениях.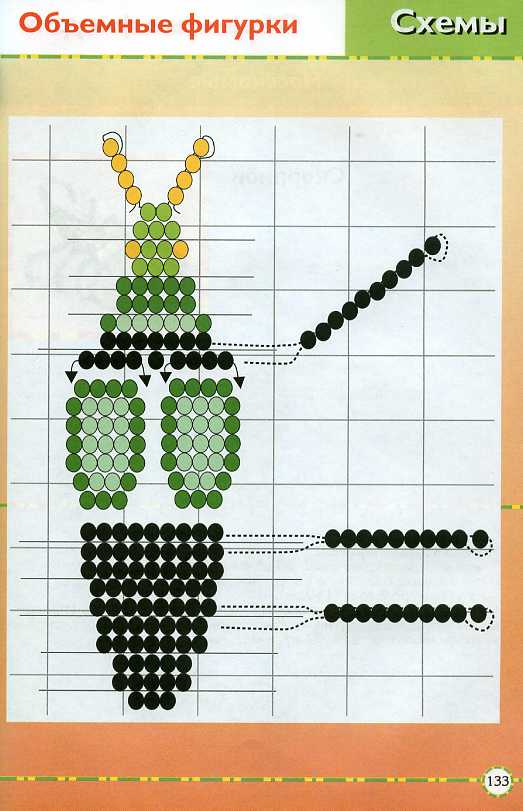 Современные методы имеют серьезные ограничения при применении к визуализации живых клеток, такие как длительное время записи и/или фотообесцвечивание. Внедряя новую оптическую схему для переключения обратимо переключаемых флуоресцентных молекул, мы демонстрируем объемную наноскопию живых клеток с разрешением менее 100 нм в 3D, большим полем зрения и минимальной интенсивностью освещения (Вт-кВт/см 2 ).
Современные методы имеют серьезные ограничения при применении к визуализации живых клеток, такие как длительное время записи и/или фотообесцвечивание. Внедряя новую оптическую схему для переключения обратимо переключаемых флуоресцентных молекул, мы демонстрируем объемную наноскопию живых клеток с разрешением менее 100 нм в 3D, большим полем зрения и минимальной интенсивностью освещения (Вт-кВт/см 2 ).
Оптические микроскопы в первую очередь передают более высокую пространственную информацию в боковых направлениях благодаря внутренним принципам формирования изображений на основе линз. Появление оптической наноскопии продемонстрировало возможность извлечения изотропной аксиальной и латеральной информации за пределами дифракционного предела с использованием подходов интерферометрии 1–3 и инженерии точечной функции рассеяния 4–6 как в детерминированных, так и в методах стохастического переключения отдельных молекул. Однако современные системы, способные передавать трехмерную информацию со сверхвысоким разрешением из образца, сегодня не подходят для визуализации живых биологических систем, особенно в течение длительного времени, либо из-за слишком длительного времени получения изображения, либо из-за фотообесцвечивания и/или фототоксичности, вызванной высокой интенсивностью освещения.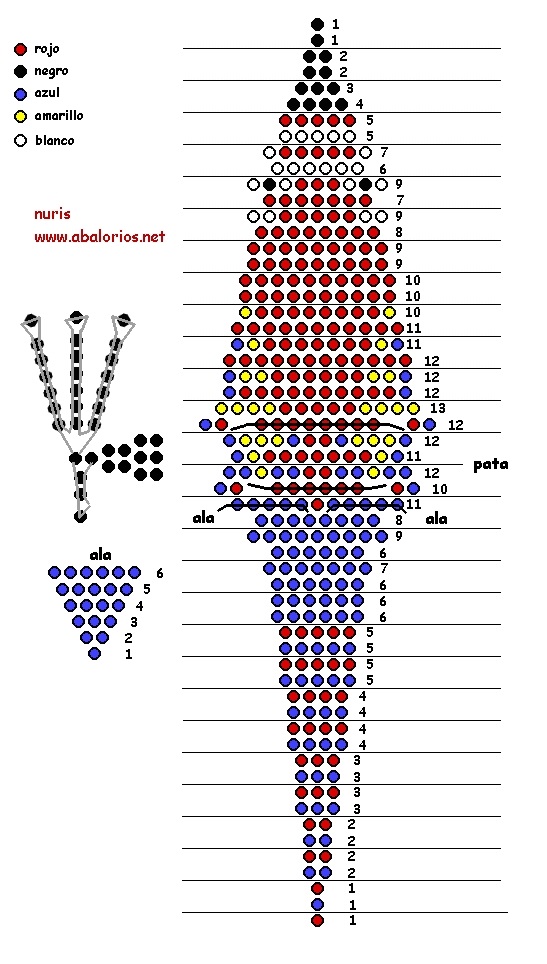 или химический препарат для сохранения эффективного моргания. Другие системы, совместимые с живыми клетками, превышают дифракционный предел только в два раза 7 , которые в осевом направлении все еще превышают 300 нм, или требуют сложных многоцелевых установок 8–10 , что сильно ограничивает удобство использования системы. Чтобы решить эту проблему, мы разработали новую схему освещения с модуляцией интенсивности по всем трем измерениям (рис. 1a-d). Рисунок представляет собой массив областей нулевой интенсивности, совмещенных с фокальной плоскостью обнаружения, с резким и почти изотропным трехмерным ограничением (рис. 1b, дополнительное примечание 7). «Нули» расположены на одинаковом расстоянии друг от друга и имеют одинаковый размер, что делает его более подходящим для схем адресного переключения, таких как в STED 9.0183 11 и РЕСОЛЬФТ 12 наноскопии, чем ранее представленные образцы 8,13 . Мы использовали 3D-модулированное освещение для переключения обратимо переключаемых флуоресцентных белков (RSFP) 14 из флуоресцентного (ВКЛ) в нефлуоресцентное (ВЫКЛ) состояние.
или химический препарат для сохранения эффективного моргания. Другие системы, совместимые с живыми клетками, превышают дифракционный предел только в два раза 7 , которые в осевом направлении все еще превышают 300 нм, или требуют сложных многоцелевых установок 8–10 , что сильно ограничивает удобство использования системы. Чтобы решить эту проблему, мы разработали новую схему освещения с модуляцией интенсивности по всем трем измерениям (рис. 1a-d). Рисунок представляет собой массив областей нулевой интенсивности, совмещенных с фокальной плоскостью обнаружения, с резким и почти изотропным трехмерным ограничением (рис. 1b, дополнительное примечание 7). «Нули» расположены на одинаковом расстоянии друг от друга и имеют одинаковый размер, что делает его более подходящим для схем адресного переключения, таких как в STED 9.0183 11 и РЕСОЛЬФТ 12 наноскопии, чем ранее представленные образцы 8,13 . Мы использовали 3D-модулированное освещение для переключения обратимо переключаемых флуоресцентных белков (RSFP) 14 из флуоресцентного (ВКЛ) в нефлуоресцентное (ВЫКЛ) состояние. Поскольку эти состояния являются долгоживущими и требуют минимальной интенсивности (Вт-кВт/см 2 ) для полного заполнения, это позволяет получить более щадящее изображение и распределить интенсивность освещения по большим площадям 15,16 при сохранении эффективного отключения. Разработка таких распараллеленных оптических схем, охватывающих большие поля зрения > 40 × 40 мкм 2 имеет решающее значение для ускорения времени записи и увеличения всего 17 .
Поскольку эти состояния являются долгоживущими и требуют минимальной интенсивности (Вт-кВт/см 2 ) для полного заполнения, это позволяет получить более щадящее изображение и распределить интенсивность освещения по большим площадям 15,16 при сохранении эффективного отключения. Разработка таких распараллеленных оптических схем, охватывающих большие поля зрения > 40 × 40 мкм 2 имеет решающее значение для ускорения времени записи и увеличения всего 17 .
Рисунок 1
а) Схематическое изображение интерференции когерентных лучей с различным наклоном. Под объективами показано соответствующее размещение сфокусированных лучей на задней фокальной плоскости вместе с их поляризацией (красные двойные стрелки). Наклон окончательного рисунка зависит от углов α 1 и α 2 , определенных здесь как угол между направлением распространения луча и оптической осью (осью z). b) : Двумерные графики показывают латеральную и осевую периодичность результирующей интерференционной картины в зависимости от углов α 1 и α 2 . Красными кружками отмечена комбинация углов, используемых для наклонных шаблонов в реализованной версии системы 3D-pRESOLFT. c) Три интерференционные картины P 1 , P 2 и P 3 показаны с соответствующими размещениями лучей на задней фокальной плоскости. Зеленые плоскости иллюстрируют геометрию плоскостей нулевой интенсивности в каждом шаблоне. d) Некогерентное наложение P 1 , P 2 и P 3 приводит к трехмерным ограниченным объемам, выделенным здесь зелеными объемами. e) Схематическое изображение последовательности изображений, используемой в визуализации 3D-pRESOLFT, показывающее смоделированные картины освещения в плоскости X-Z в правильном временном порядке и продолжительности.
b) : Двумерные графики показывают латеральную и осевую периодичность результирующей интерференционной картины в зависимости от углов α 1 и α 2 . Красными кружками отмечена комбинация углов, используемых для наклонных шаблонов в реализованной версии системы 3D-pRESOLFT. c) Три интерференционные картины P 1 , P 2 и P 3 показаны с соответствующими размещениями лучей на задней фокальной плоскости. Зеленые плоскости иллюстрируют геометрию плоскостей нулевой интенсивности в каждом шаблоне. d) Некогерентное наложение P 1 , P 2 и P 3 приводит к трехмерным ограниченным объемам, выделенным здесь зелеными объемами. e) Схематическое изображение последовательности изображений, используемой в визуализации 3D-pRESOLFT, показывающее смоделированные картины освещения в плоскости X-Z в правильном временном порядке и продолжительности.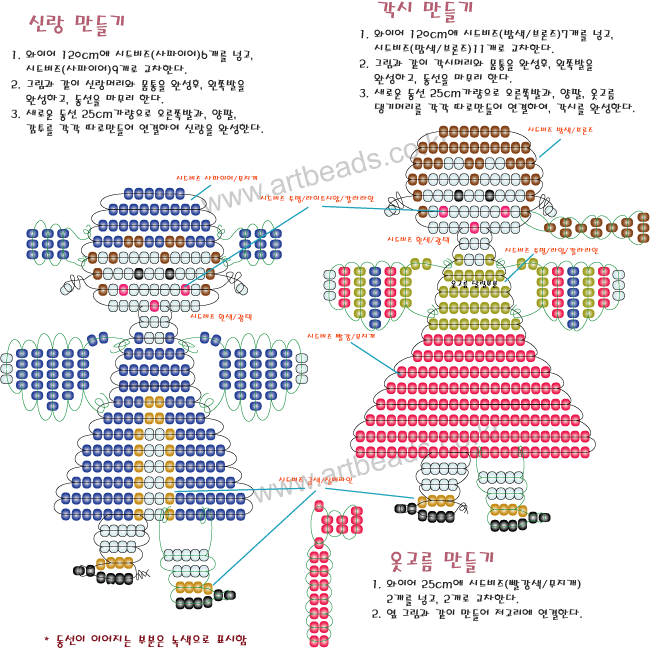 Крайнее правое изображение показывает рассчитанное ожидаемое распределение излучения во время считывания в результате полной последовательности источников освещения.
Крайнее правое изображение показывает рассчитанное ожидаемое распределение излучения во время считывания в результате полной последовательности источников освещения.
Теоретически неограниченное 3D-разрешение нашей системы полностью обязано новому шаблону выключения, который создается с использованием некогерентного наложения трех различных шаблонов стоячей волны. Каждая картина стоячей волны создает плоскости нулевой интенсивности в освещенном объеме, как показано на рисунке 1c. Точки, в которых пересекаются плоскости всех трех шаблонов, будут центрами результирующих объемов нулевой интенсивности (рис. 1d). Каждая картина стоячей волны создается интерференцией двух когерентных плоских волн, выходящих из объектива в заданных направлениях. Две модели стоячих волн, P 1 и P 2 наклонены относительно оптической оси. Этот наклон придает окончательному паттерну осевую модуляцию. Наклон достигается за счет смещения двух сфокусированных пятен на задней фокальной плоскости таким образом, чтобы они располагались асимметрично относительно оптической оси (рис.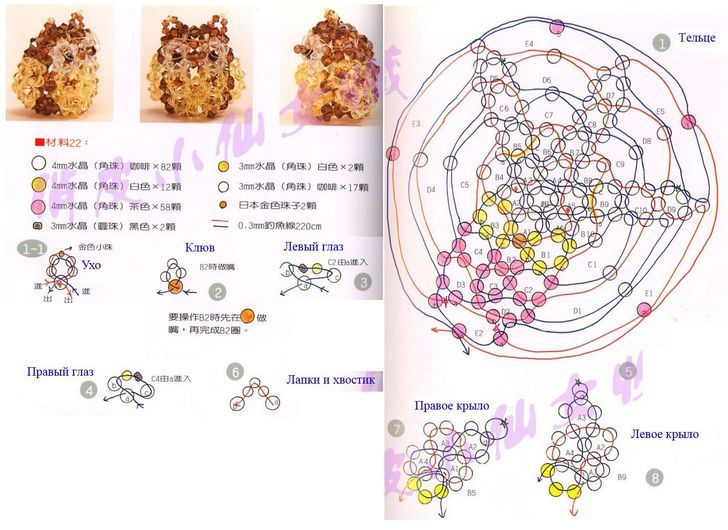 1а). Третий паттерн, P 3 , симметричный в задней фокальной плоскости, ограничивает объемы в конечном латеральном измерении. Точную осевую и латеральную периодичность рисунка можно настроить, изменяя положение фокусов на задней фокальной плоскости. Поскольку периодичность картины в заданном направлении обратно пропорциональна ограничению флуоресценции при определенной интенсивности, настройка периодичности повлияет на свойства системы визуализации. Для изображения, продемонстрированного здесь, мы выбрали конфигурацию, которая минимизировала осевую периодичность и, таким образом, максимизировала потенциальное осевое разрешение. В нашей конфигурации осевая и латеральная периодичность составляют 480 нм и 360 нм соответственно.
1а). Третий паттерн, P 3 , симметричный в задней фокальной плоскости, ограничивает объемы в конечном латеральном измерении. Точную осевую и латеральную периодичность рисунка можно настроить, изменяя положение фокусов на задней фокальной плоскости. Поскольку периодичность картины в заданном направлении обратно пропорциональна ограничению флуоресценции при определенной интенсивности, настройка периодичности повлияет на свойства системы визуализации. Для изображения, продемонстрированного здесь, мы выбрали конфигурацию, которая минимизировала осевую периодичность и, таким образом, максимизировала потенциальное осевое разрешение. В нашей конфигурации осевая и латеральная периодичность составляют 480 нм и 360 нм соответственно.
В сочетании с RSFP, такими как rsEGFP2 14 , выключение, вызванное синим светом, позволяет нам отпечатывать паттерны распределения состояний в образце, которые затем при флуоресцентном возбуждении преобразуются в пространственный паттерн ожидаемого излучения (рис.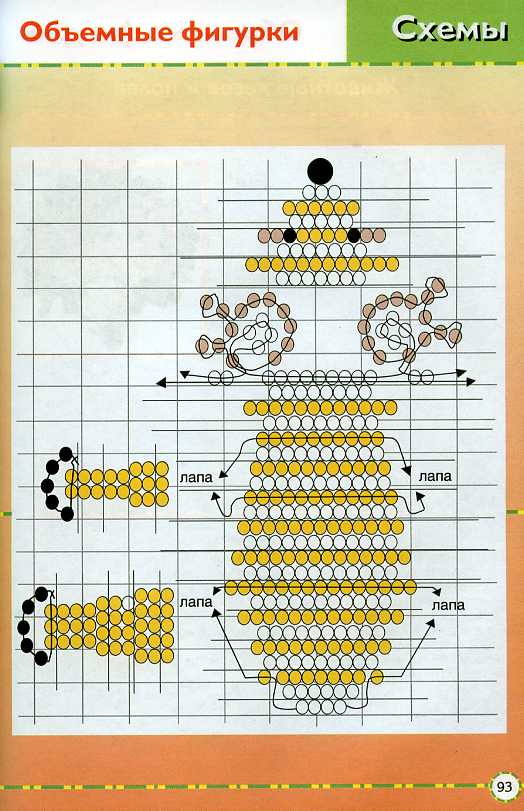 1e). ). В нашей оптической схеме мультифокальный рисунок на 405 нм используется для включения любых РЗП, расположенных в фокальных пятнах. Острые нулевые области шаблона OFF-переключения используются для резкого ограничения популяции RSFP во включенном состоянии и создания шаблона излучения, состоящего в основном из четко разделенных, но резко ограниченных трехмерных областей, расположенных в фокальной плоскости микроскопа. Поскольку эти области исследуются при втором многоочаговом освещении, мы можем количественно определить относительную плотность флуорофора в этой координате в образце.
1e). ). В нашей оптической схеме мультифокальный рисунок на 405 нм используется для включения любых РЗП, расположенных в фокальных пятнах. Острые нулевые области шаблона OFF-переключения используются для резкого ограничения популяции RSFP во включенном состоянии и создания шаблона излучения, состоящего в основном из четко разделенных, но резко ограниченных трехмерных областей, расположенных в фокальной плоскости микроскопа. Поскольку эти области исследуются при втором многоочаговом освещении, мы можем количественно определить относительную плотность флуорофора в этой координате в образце.
Мы измерили эффективную схему выключения (рис. 2а) путем сканирования флуоресцентных шариков, встроенных в Mowiol, где измеренная периодичность 680 нм соответствует теоретическим предсказаниям. Из-за несоответствия показателей преломления стекла и образца (1,51 в стекле и 1,33 в образце) периодичность сжимается с 680 нм в стекле/мовиоле до 480 нм в образце, что дает почти изотропное удержание. Учитывая кинетику переключения rsEGFP2 и пиковую энергию 0,7 Дж/см 2 для шаблонов P 1 и P 2 , результирующий ограниченный флуоресцентный объем будет иметь FWHM около 78 нм (рис. 2b) вдоль z и 59 нм вдоль x . Добавление P 3 с пиковой интенсивностью 1,4 Дж/см 2 также ограничивает объемы вдоль y до FWHM 59 нм.
Учитывая кинетику переключения rsEGFP2 и пиковую энергию 0,7 Дж/см 2 для шаблонов P 1 и P 2 , результирующий ограниченный флуоресцентный объем будет иметь FWHM около 78 нм (рис. 2b) вдоль z и 59 нм вдоль x . Добавление P 3 с пиковой интенсивностью 1,4 Дж/см 2 также ограничивает объемы вдоль y до FWHM 59 нм.
Рисунок 2
a) Слева показана экспериментально измеренная картина интенсивности при освещении образца двумя наклонными интерференционными картинами. Справа измерение помещено в более широкий контекст, показывающий моделирование большей области. Здесь также проиллюстрирован эффект границы раздела показателей преломления между покровным стеклом и образцом, приводящий к осевому сжатию рисунка. b) Профиль осевой линии трех различных схем освещения (ВКЛ, ВЫКЛ и считывание) показан на левом графике, а также результирующее относительное ожидаемое распределение излучения вдоль той же линии с вычисленной полушириной центральной гауссовой диаграммы. как ~ 78 нм. c) На графике показана зависимость центральной полуширины от энергии выключенного освещения, где энергия представляет собой пиковую энергию диаграммы P 1 и P 2 каждой. d) На панели показаны смоделированные и измеренные изображения 3D-pRESOLFT. Виртуальный образец, используемый в моделировании, пытается имитировать структуру и маркировку образца, наблюдаемого в измеренных данных, и создается в виде двух маркированных листов с различным осевым расстоянием. Листы помечены 20 флуорофорами на воксел размером 20×20×20 нм. И измеренные, и смоделированные данные собираются с использованием только шаблона P 9.0217 1 и P 2 . Чтобы продемонстрировать заключение с максимальным контрастом. e) На графиках показаны профили линий вдоль линий, обозначенных d . Все показанные профили линий соответствуют двум ожидаемым эффективным PSF ситуации визуализации, см. Дополнительные примечания 1 и 2.
как ~ 78 нм. c) На графике показана зависимость центральной полуширины от энергии выключенного освещения, где энергия представляет собой пиковую энергию диаграммы P 1 и P 2 каждой. d) На панели показаны смоделированные и измеренные изображения 3D-pRESOLFT. Виртуальный образец, используемый в моделировании, пытается имитировать структуру и маркировку образца, наблюдаемого в измеренных данных, и создается в виде двух маркированных листов с различным осевым расстоянием. Листы помечены 20 флуорофорами на воксел размером 20×20×20 нм. И измеренные, и смоделированные данные собираются с использованием только шаблона P 9.0217 1 и P 2 . Чтобы продемонстрировать заключение с максимальным контрастом. e) На графиках показаны профили линий вдоль линий, обозначенных d . Все показанные профили линий соответствуют двум ожидаемым эффективным PSF ситуации визуализации, см. Дополнительные примечания 1 и 2.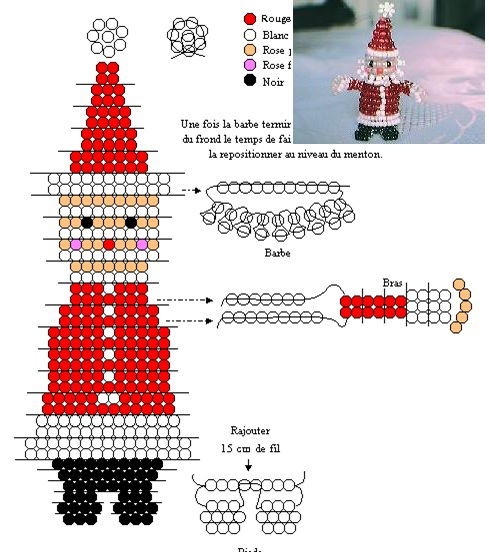 На левых графиках показаны ширины центральных гауссианов, а справа показано разделение между пиками.
На левых графиках показаны ширины центральных гауссианов, а справа показано разделение между пиками.
Размер ограниченных объемов описывает потенциальное разрешение системы визуализации при этих параметрах метки и визуализации. Зависимость между осевой полушириной и энергией выключающего освещения показана на рис. 2в.
Несмотря на то, что выход разрешения за пределы дифракционного предела происходит из-за описанного выше шаблона выключения, конечное качество изображения сильно зависит от мультифокальных шаблонов 16 . Добавление мультифокального включения и считывания означает, что флуорофоры включаются и возбуждаются только в ограниченных объемах, расположенных в фокальной плоскости обнаружения. Это сводит к минимуму количество излучения не в фокусе, которое ухудшает отношение сигнал/шум изображения, а также обеспечивает гибкость включения и считывания подмножества нулевых объемов, что минимизирует перекрестные помехи излучения и повышает отношение сигнал/шум изображения 16 .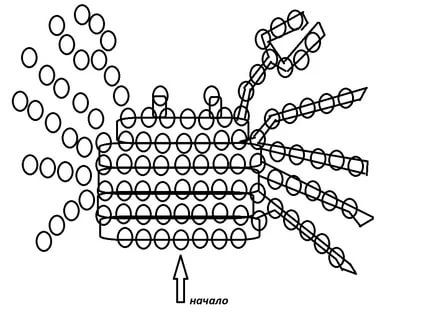
Чтобы не полагаться исключительно на теоретические заявления о разрешении, мы сосредоточимся на практических демонстрациях достижимого разрешения. С этой целью мы визуализировали клетки U2OS, помеченные LifeAct-rsEGFP2, и сравнили полученную разрешающую способность с теоретическими расчетами и вычислительным моделированием (рис. 2d-e). Результаты подтверждают, что система способна различать аксиально разделенные структуры на расстоянии, приближающемся к 100 нм. Это утверждение подтверждается наблюдением глубины модуляции около 60% для структур, разделенных расстоянием 116 нм, и измерением FWHM ограниченной центральной гауссианы около 80 нм (подробности см. В Дополнительных примечаниях 1 и 2). Все значения находятся в хорошем согласии с теорией и моделированием. В качестве дополнительного примечания следует признать, что теоретическая полоса пропускания системы визуализации не ограничена, ограниченные объемы имеют гауссовы профили во всех направлениях, которые по своей сути имеют бесконечную поддержку частоты.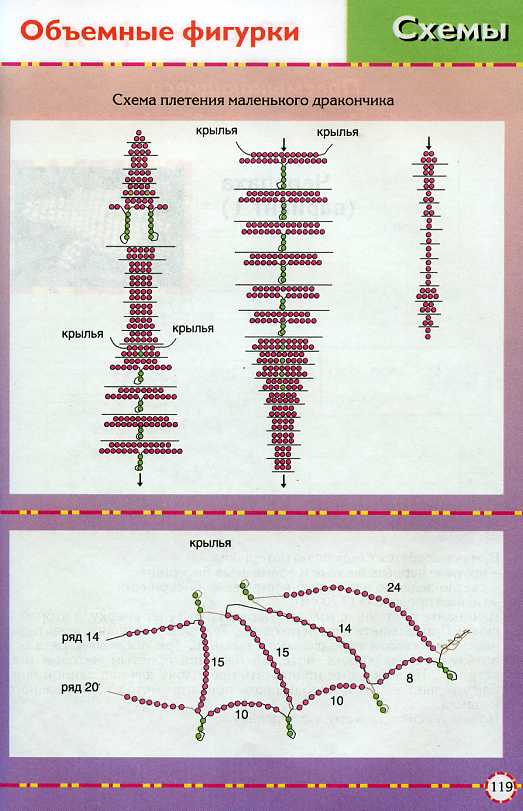 Количество высокочастотной информации может быть увеличено за счет увеличения энергии выключающего света, т.е. увеличения ограничения. Это, однако, изменит уровни сигнала к шуму и сигнала к фону способами, которые нетривиальным образом зависят от характеристик флуорофора и маркировки. Другие параметры, такие как плотность маркировки и тип отображаемой структуры, также изменяют эффективное разрешение системы (дополнительный рисунок 6). Более глубокий анализ этих соображений поможет еще больше углубить наше понимание возможностей и ограничений систем визуализации на основе RSFP.
Количество высокочастотной информации может быть увеличено за счет увеличения энергии выключающего света, т.е. увеличения ограничения. Это, однако, изменит уровни сигнала к шуму и сигнала к фону способами, которые нетривиальным образом зависят от характеристик флуорофора и маркировки. Другие параметры, такие как плотность маркировки и тип отображаемой структуры, также изменяют эффективное разрешение системы (дополнительный рисунок 6). Более глубокий анализ этих соображений поможет еще больше углубить наше понимание возможностей и ограничений систем визуализации на основе RSFP.
Мы также демонстрируем улучшение осевого разрешения, визуализируя очень разные типы структур, включая заведомо тусклые и редкие структуры промежуточных филаментов, такие как клетки U2OS, эндогенно экспрессирующие Vimentin-rsEGFP2 (рис. 3a-b), а также более плотную и яркую структуру U2OS. клетки, трансфицированные rsEGFP2-Omp25, маркирующие наружную мембрану митохондрий (рис. 3с). Динамика митохондрий также визуализируется с помощью покадровой визуализации XZ-срезов на рис. 3d, где, в частности, можно увидеть осевую реорганизацию с высоким осевым разрешением системы. Для дальнейшего изучения и демонстрации способности визуализации 3D-pRESOLFT в живых клетках мы записали всю трехмерную сеть митохондрий в клетках U2OS, трансфицированных rsEGFP2-Omp25 в качестве маркера внешней мембраны. На рис. 3д показан полный объем двух клеток, зарегистрированный с ограничением по всем трем схемам освещения (P 1 -P 3 ). В увеличенном масштабе подчеркивается способность системы точно измерять трехмерную форму и «полый» объем каждой отдельной митохондрии даже в близко расположенных областях, таких как ядерная близость.
3d, где, в частности, можно увидеть осевую реорганизацию с высоким осевым разрешением системы. Для дальнейшего изучения и демонстрации способности визуализации 3D-pRESOLFT в живых клетках мы записали всю трехмерную сеть митохондрий в клетках U2OS, трансфицированных rsEGFP2-Omp25 в качестве маркера внешней мембраны. На рис. 3д показан полный объем двух клеток, зарегистрированный с ограничением по всем трем схемам освещения (P 1 -P 3 ). В увеличенном масштабе подчеркивается способность системы точно измерять трехмерную форму и «полый» объем каждой отдельной митохондрии даже в близко расположенных областях, таких как ядерная близость.
Рисунок 3
а) Полный X-Z-срез клетки U2OS, эндогенно экспрессирующей виментин-rsEGFP2, визуализированный в режиме 3D pRESOLFT. b) Увеличенное изображение и показывает сравнение между 3D pRESOLFT и улучшенным конфокальным режимом и демонстрирует, что как латеральное, так и аксиальное расширение разрешения сохраняется также в печально известной эндогенно помеченной нитевидной структуре виментина. Профили линий, нанесенные на график, измеряются вдоль линии, отмеченной красными стрелками. Трехмерный профиль pRESOLFT показан красной линией, а улучшенный конфокальный снимок показан серым цветом. Обе кривые нормированы на максимальную интенсивность кривой. c) Митохондрии, меченные rsEGFP2-Omp25, визуализированные как в расширенном конфокальном, так и в 3D pRESOLFT*. Звездочка (*) означает, что изображения были подвергнуты деконволюции, как описано в разделе методов, здесь с использованием 70 итераций. Изображения представляют собой увеличенные изображения, взятые из большего среза, показанного на дополнительном рис. 5. Верхняя и нижняя мембраны небольшого митохондриального отсека на расстоянии ~ 110 нм указаны на правом 3D-изображении pRESOLFT *. d) Сверху вниз мы показываем X-Z-срез из 3D pRESOLFT* (50 итераций) покадровой записи клеток U2OS, меченных rsEGFP2-Omp25, в течение 2 минут. Серия продемонстрировала, в частности, способность системы выявлять аксиальную митохондриальную реорганизацию с высоким временным разрешением.
Профили линий, нанесенные на график, измеряются вдоль линии, отмеченной красными стрелками. Трехмерный профиль pRESOLFT показан красной линией, а улучшенный конфокальный снимок показан серым цветом. Обе кривые нормированы на максимальную интенсивность кривой. c) Митохондрии, меченные rsEGFP2-Omp25, визуализированные как в расширенном конфокальном, так и в 3D pRESOLFT*. Звездочка (*) означает, что изображения были подвергнуты деконволюции, как описано в разделе методов, здесь с использованием 70 итераций. Изображения представляют собой увеличенные изображения, взятые из большего среза, показанного на дополнительном рис. 5. Верхняя и нижняя мембраны небольшого митохондриального отсека на расстоянии ~ 110 нм указаны на правом 3D-изображении pRESOLFT *. d) Сверху вниз мы показываем X-Z-срез из 3D pRESOLFT* (50 итераций) покадровой записи клеток U2OS, меченных rsEGFP2-Omp25, в течение 2 минут. Серия продемонстрировала, в частности, способность системы выявлять аксиальную митохондриальную реорганизацию с высоким временным разрешением. Изображения получены с интервалом 5-6 секунд при времени записи кадра 1,7 с. Полная запись производит 20 X-Z-срезов, одновременно распределенных на расстоянии 720 нм в объеме. e) Объемное изображение митохондриальной сети в большом поле зрения в живой клетке U2OS, меченной rsEGFP2-Omp25. При увеличении показан митохондриальный комплекс в высоком 3D-разрешении. Повышение 3D-разрешения позволяет различать и сегментировать меньший сферический митохондриальный фрагмент/везикулу, расположенный непосредственно под более крупным. Объемные изображения показывают необработанные реконструированные данные, в то время как двухмерный X-Z-срез, показанный в правом нижнем углу, извлечен из трехмерного объемного сечения (40 итераций).
Изображения получены с интервалом 5-6 секунд при времени записи кадра 1,7 с. Полная запись производит 20 X-Z-срезов, одновременно распределенных на расстоянии 720 нм в объеме. e) Объемное изображение митохондриальной сети в большом поле зрения в живой клетке U2OS, меченной rsEGFP2-Omp25. При увеличении показан митохондриальный комплекс в высоком 3D-разрешении. Повышение 3D-разрешения позволяет различать и сегментировать меньший сферический митохондриальный фрагмент/везикулу, расположенный непосредственно под более крупным. Объемные изображения показывают необработанные реконструированные данные, в то время как двухмерный X-Z-срез, показанный в правом нижнем углу, извлечен из трехмерного объемного сечения (40 итераций).
В заключение мы представляем новый подход к 3D-изображениям сверхвысокого разрешения с минимальной интенсивностью освещения в больших полях зрения, который впервые в целых живых клетках позволяет проводить объемные исследования с разрешениями, намного превышающими дифракционный предел во всех трех измерениях. Пространственное распределение флуоресцентного излучения этих меток теперь можно точно контролировать в 3D с помощью новой комбинации интерференционных картин. Этот метод основан на использовании обратимо переключаемых флуорофоров и демонстрируется здесь с использованием rsEGFP2 9.0183 14 , но может быть легко применен к другим датчикам с реверсивным переключением зеленого и красного излучения 18 . Полученные изображения показывают как боковое, так и осевое разрешение ниже 100 нм без предварительной информации или обработки. Хотя в настоящем документе представлены надежные доказательства концепции, дальнейшая разработка стратегий маркировки, таких как временное связывание 19 , имеет большой потенциал для обеспечения еще более длительной объемной покадровой визуализации. Для более глубокой визуализации тканей в будущем будет реализована адаптивная коррекция волнового фронта 20 может оказаться необходимым для сохранения световых паттернов в этих сложных средах.
Пространственное распределение флуоресцентного излучения этих меток теперь можно точно контролировать в 3D с помощью новой комбинации интерференционных картин. Этот метод основан на использовании обратимо переключаемых флуорофоров и демонстрируется здесь с использованием rsEGFP2 9.0183 14 , но может быть легко применен к другим датчикам с реверсивным переключением зеленого и красного излучения 18 . Полученные изображения показывают как боковое, так и осевое разрешение ниже 100 нм без предварительной информации или обработки. Хотя в настоящем документе представлены надежные доказательства концепции, дальнейшая разработка стратегий маркировки, таких как временное связывание 19 , имеет большой потенциал для обеспечения еще более длительной объемной покадровой визуализации. Для более глубокой визуализации тканей в будущем будет реализована адаптивная коррекция волнового фронта 20 может оказаться необходимым для сохранения световых паттернов в этих сложных средах. Мы считаем, что этот метод и будущие многоцветные разработки могут быть очень полезны для ряда исследований клеточной биологии, направленных на анализ трехмерного распределения и динамики органелл и молекул в живых и интактных биологических системах.
Мы считаем, что этот метод и будущие многоцветные разработки могут быть очень полезны для ряда исследований клеточной биологии, направленных на анализ трехмерного распределения и динамики органелл и молекул в живых и интактных биологических системах.
Вклад автора
И.Т. разработал и курировал проект. А.Б. спроектировал и построил микроскоп с соответствующим программным обеспечением. Ф.П. подготовили образцы. ЭТО. и А.Б. написал рукопись при содействии всех авторов.
Резюме редактора
Новая оптическая схема для параллельной наноскопии RESOLFT позволяет получать объемные изображения живых клеток с расширенным пространственным разрешением в трех измерениях.
Онлайн-методы
Экспериментальная установка
3D-изображения pRESOLFT получают с помощью специального микроскопа на основе обычных оптических и электрооптических компонентов. Схема оптической установки представлена на дополнительном рисунке 7. Оптическая установка может быть разделена на три основные части: 1-два пути для создания многофокусных паттернов для включения (лазер 405 нм) и считывания (488 нм). лазер) 2-Лазерные траектории, используемые для создания схемы переключения ВЫКЛ (49лазеры с длиной волны 1 нм) 3-Путь обнаружения, который отображает излучаемую флуоресценцию на камеру sCMOS. 1. Пути двух микролинз генерируются лазерным источником с волоконной связью (Cobolt 06-MLD 488 нм и 405 нм с фильтром Chroma ET405/10X и ET488/10X соответственно), который после прохождения коллимирующей линзы через массив микролинз (Thorlabs MLA150 -7АР-М) с расстоянием между линзами 150 мкм. Плоскость изображения после микролинз уменьшена в два раза с помощью телескопа 4f. Затем лучи объединяются в основной оптический путь с помощью неполяризующего светоделителя 50/50 (Thorlabs CCM1-BS013/MB) для пути 488 нм и дихроичного зеркала (Semrock Di03-R442-t1-25×36) для пути 488 нм. путь 405 нм. Основной оптический путь состоит из оптимизированной тубусной линзы и пары объективов (объектив Leica STED-Orange 1.4 NA Oil), дающих приблизительно 104-кратное уменьшение. Конечная периодичность многоочагового рисунка в образце составляет 720 нм.
лазер) 2-Лазерные траектории, используемые для создания схемы переключения ВЫКЛ (49лазеры с длиной волны 1 нм) 3-Путь обнаружения, который отображает излучаемую флуоресценцию на камеру sCMOS. 1. Пути двух микролинз генерируются лазерным источником с волоконной связью (Cobolt 06-MLD 488 нм и 405 нм с фильтром Chroma ET405/10X и ET488/10X соответственно), который после прохождения коллимирующей линзы через массив микролинз (Thorlabs MLA150 -7АР-М) с расстоянием между линзами 150 мкм. Плоскость изображения после микролинз уменьшена в два раза с помощью телескопа 4f. Затем лучи объединяются в основной оптический путь с помощью неполяризующего светоделителя 50/50 (Thorlabs CCM1-BS013/MB) для пути 488 нм и дихроичного зеркала (Semrock Di03-R442-t1-25×36) для пути 488 нм. путь 405 нм. Основной оптический путь состоит из оптимизированной тубусной линзы и пары объективов (объектив Leica STED-Orange 1.4 NA Oil), дающих приблизительно 104-кратное уменьшение. Конечная периодичность многоочагового рисунка в образце составляет 720 нм.
2) Пути выключения состоят из трех отдельных путей, исходящих из двух разных, но идентичных лазерных источников (Cobolt Calypso 491 нм DPSS). С помощью поляризационного светоделителя 50/50 (Thorlabs CCM1-PBS251/M) один из лучей разделяется на два, что дает в сумме три луча. Два из них, луч 1 и луч 2, имеют горизонтальную поляризацию, а последний, луч 3, имеет вертикальную поляризацию. Два пучка с горизонтальной поляризацией направляются на дифракционную решетку (фазо-дифракционные решетки линий SiO2 высотой 437 нм с периодом 25 мкм от Laser Laboratorium Göttingen) с горизонтальными линиями решетки. Эти лучи создадут частичный узор P 1 и P 2 на рис. 1с. Зеркала, предшествующие дифракционной сетке, расположены так, чтобы эти лучи попадали на сетку под углом 1,125 градуса в противоположных направлениях, дополнительный рисунок 7. Этот небольшой наклон в плоскости дифракционных сеток дает асимметрию в задней фокальной плоскости. Поскольку эти два луча исходят от разных лазерных источников, они будут некогерентными во времени и, таким образом, не будут мешать друг другу. Луч с вертикальной поляризацией направляется на дифракционную решетку с вертикальными штрихами. Этот луч совмещен симметрично с оптической осью и создает частичное изображение P 3 . После прохождения через две решетки лучи объединяются вторым поляризационным светоделителем. Объединенные лучи проходят через телескоп, между которыми помещается физическая маска, чтобы заблокировать все, кроме порядков дифракции +1 и -1 решеток. Поскольку -1-й порядок луча 1 и +1-й порядок луча 2 оба падают на оптическую ось в плоскости маски и должны быть пропущены, в то время как 0-й порядок луча 3 должен быть заблокирован, очень небольшое намеренное смещение луча 3 введено, чтобы разрешить блокировку 0-го порядка без блокировки -1 и +1 порядков лучей 1 и 2 соответственно. Это внесет незначительный наклон также в частичный шаблон P3. Однако это не окажет существенного влияния на окончательный шаблон и производительность системы. Для расчетов периодичности окончательного шаблона см. Дополнительное примечание 7
Луч с вертикальной поляризацией направляется на дифракционную решетку с вертикальными штрихами. Этот луч совмещен симметрично с оптической осью и создает частичное изображение P 3 . После прохождения через две решетки лучи объединяются вторым поляризационным светоделителем. Объединенные лучи проходят через телескоп, между которыми помещается физическая маска, чтобы заблокировать все, кроме порядков дифракции +1 и -1 решеток. Поскольку -1-й порядок луча 1 и +1-й порядок луча 2 оба падают на оптическую ось в плоскости маски и должны быть пропущены, в то время как 0-й порядок луча 3 должен быть заблокирован, очень небольшое намеренное смещение луча 3 введено, чтобы разрешить блокировку 0-го порядка без блокировки -1 и +1 порядков лучей 1 и 2 соответственно. Это внесет незначительный наклон также в частичный шаблон P3. Однако это не окажет существенного влияния на окончательный шаблон и производительность системы. Для расчетов периодичности окончательного шаблона см. Дополнительное примечание 7
3) Детектирование выполнено в виде обычного широкопольного микроскопа. Поскольку основной путь возбуждения отражается от длиннопроходного дихроичного зеркала (Semrock Di03-R488-t1-25×36) перед попаданием в объектив, испускаемый флуоресцентный свет проходит через дихроичное зеркало и отображается на sCMOS-камере (Hamamatsu ORCA). -Fusion) с использованием стандартного тубуса 200 мм. Тракт обнаружения также содержит дополнительный полосовой фильтр (Chroma ET535/70m) для минимизации окружающего света и два режекторных фильтра (Chroma ZET405NF и ZET488NF) для устранения любых отражений.
Поскольку основной путь возбуждения отражается от длиннопроходного дихроичного зеркала (Semrock Di03-R488-t1-25×36) перед попаданием в объектив, испускаемый флуоресцентный свет проходит через дихроичное зеркало и отображается на sCMOS-камере (Hamamatsu ORCA). -Fusion) с использованием стандартного тубуса 200 мм. Тракт обнаружения также содержит дополнительный полосовой фильтр (Chroma ET535/70m) для минимизации окружающего света и два режекторных фильтра (Chroma ZET405NF и ZET488NF) для устранения любых отражений.
Реконструкция и обработка изображения
Чтобы реконструировать окончательное изображение (2D или 3D) из необработанных данных 3D preRESOLFT, необходимо количественно определить излучение от каждого ограниченного объема в каждом кадре. Массив излучающих объемов в образце в каждом цикле сканирования отображается на датчике камеры, в результате чего на датчике формируется массив ФРТ с дифракционным ограничением. Из предварительного знания шаблонов освещения известен центр каждой PSF, и кадр камеры сегментирован на подобласти, каждая из которых содержит одну обнаруженную PSF. Каждая подобласть затем обрабатывается индивидуально, и интенсивность центральной PSF количественно определяется методом наименьших квадратов центрированной функции Гаусса поверх постоянного фона так же, как это было сделано в нашей предыдущей работе 9.0183 16 . Окончательное изображение соответствует коэффициентам, связанным с центральной дифракцией, ограниченной гауссианой от подгонки. Алгоритм реконструкции реализован на Python с обработкой с ускорением на графическом процессоре (CUDA) и реконструирует полные объемные данные за секунды.
Каждая подобласть затем обрабатывается индивидуально, и интенсивность центральной PSF количественно определяется методом наименьших квадратов центрированной функции Гаусса поверх постоянного фона так же, как это было сделано в нашей предыдущей работе 9.0183 16 . Окончательное изображение соответствует коэффициентам, связанным с центральной дифракцией, ограниченной гауссианой от подгонки. Алгоритм реконструкции реализован на Python с обработкой с ускорением на графическом процессоре (CUDA) и реконструирует полные объемные данные за секунды.
Оптическая обработка излучения в сочетании с реконструкцией, описанной выше, приводит к модели формирования изображения, в которой окончательные необработанные реконструированные объемы могут быть описаны как свертка базовой плотности образца с полученной трехмерной эффективной функцией рассеяния точки (PSF) с добавлен шум. Эффективный PSF может быть хорошо аппроксимирован как сумма более широкой функции Гаусса, ограниченной дифракцией, и узкой функции Гаусса со сверхразрешением, см. Дополнительное примечание 1.4. Этот тип модели формирования изображения хорошо подходит для обычной деконволюции Ричардсона-Люси. Точно вычисляя эффективную PSF для заданных параметров изображения, деконволюция позволяет значительно увеличить контрастность изображения на самых высоких пространственных частотах. Деконволюция выполняется с помощью пользовательского сценария, реализованного на Python, который позволяет легко адаптировать эффективную PSF к используемым параметрам визуализации.
Дополнительное примечание 1.4. Этот тип модели формирования изображения хорошо подходит для обычной деконволюции Ричардсона-Люси. Точно вычисляя эффективную PSF для заданных параметров изображения, деконволюция позволяет значительно увеличить контрастность изображения на самых высоких пространственных частотах. Деконволюция выполняется с помощью пользовательского сценария, реализованного на Python, который позволяет легко адаптировать эффективную PSF к используемым параметрам визуализации.
Подготовка образца
Клетки U2OS (ATCC® HTB-96™) культивировали в среде Игла, модифицированной Дульбекко (DMEM) (Thermo Fisher Scientific, 41966029) с добавлением 10% (об./об.) эмбриональной бычьей сыворотки (Thermo Fisher Scientific, 10270106), 1% пенициллин-стрептомицин (Sigma Aldrich, P4333) и выдерживали при 37°C и 5% CO2 во влажном инкубаторе. Для трансфекции 2×10 5 клеток на лунку высевали на покровные стекла в шестилуночный планшет. Через сутки клетки трансфицировали с помощью FuGENE (Promega, E2311) в соответствии с инструкциями производителя. Через 24–36 ч после трансфекции клетки промывали раствором фосфатно-солевого буфера (PBS), помещали в камеру со средой Лейбовица L-15, не содержащей фенолового красного (Thermo Fisher Scientific, 21083027), и визуализировали.
Через 24–36 ч после трансфекции клетки промывали раствором фосфатно-солевого буфера (PBS), помещали в камеру со средой Лейбовица L-15, не содержащей фенолового красного (Thermo Fisher Scientific, 21083027), и визуализировали.
Благодарности
И.Т. благодарит стартовый грант ERC MoNaLISA (http://dx.doi.org/10.13039/501100000781) и Шведский фонд стратегических исследований за поддержку проекта.
Ссылки
- ↵
Schmidt, R. et al. Сферическое наноразмерное фокусное пятно распутывает внутреннюю часть клеток. Nat Methods 5, 539–544, doi:10.1038/nmeth.1214 (2008).
Штенгель Г. и др. Интерферометрическая флуоресцентная микроскопия сверхвысокого разрешения разрешает трехмерную клеточную ультраструктуру. Proc Natl Acad Sci U S A 106, 3125–3130, doi:10.1073/pnas.0813131106 (2009).
- ↵
Акино, Д. и др. Двухцветная наноскопия трехмерных объемов путем обнаружения 4Pi стохастически переключаемых флуорофоров.
 Nat Methods 8, 353–359, doi:10.1038/nmeth.1583 (2011).
Nat Methods 8, 353–359, doi:10.1038/nmeth.1583 (2011). - ↵
Хуан, Б., Ван, В., Бейтс, М. и Чжуан, X. Трехмерное изображение со сверхвысоким разрешением с помощью стохастической оптической реконструктивной микроскопии. Science 319, 810–813, doi:10.1126/science.1153529 (2008).
Juette, M. F. et al. Трехмерная флуоресцентная микроскопия толстых образцов с разрешением менее 100 нм. N at Methods 5, 527–529, doi:10.1038/nmeth.1211 (2008).
- ↵
Павани С.Р. и другие. Трехмерное изображение флуоресценции одной молекулы за пределами дифракционного предела с использованием функции рассеяния точки двойной спирали. Proc Natl Acad Sci U S A 106, 2995–2999, doi:10.1073/pnas.0
5106 (2009).
- ↵
Шао, Л., Кнер, П., Рего, Э. Х., Матс и Густафссон, Г. Л. Трехмерная микроскопия живых целых клеток со сверхвысоким разрешением с использованием структурированного освещения .
 doi: 10.1038/nmeth.1734.
doi: 10.1038/nmeth.1734. - ↵
Шао, Л. и др. I5S: широкопольная световая микроскопия с разрешением 100 нм в трех измерениях. Biophys J 94, 4971–4983, doi:10.1529/biophysj.107.120352 (2008).
Li, D. et al. Визуализация динамики эндоцитов и цитоскелета в структурированном освещении с расширенным разрешением . doi:10.1126/science.aab3500.
- ↵
Бом, У., Хелл, С.В. и Шмидт, Р. Наноскопия 4Pi-RESOLFT. Nat Commun 7, 10504, doi: 10.1038/ncomms10504 (2016).
- ↵
Клар, Т. А. и Хелл, С. В. Субдифракционное разрешение в флуоресцентной микроскопии дальнего поля. Opt Lett 24, 954–956, doi:10.1364/ol.24.000954 (1999).
- ↵
Grotjohann, T. et al. Полностью оптическое изображение и запись без ограничений по дифракции с фотохромным GFP. Nature 478, 204–208, doi:10.1038/nature10497 (2011).

- ↵
Xue, Y. & So, P.T.C. Трехмерное высокопроизводительное изображение со сверхвысоким разрешением с помощью STED-микроскопии со структурированным освещением. Opt Express 26, 20920–20928, doi: 10.1364/OE.26.020920 (2018).
- ↵
Grotjohann, T. et al. rsEGFP2 обеспечивает быструю наноскопию RESOLFT живых клеток. Elife 1, e00248, doi: 10.7554/eLife.00248 (2012).
- ↵
Чмыров А. и др. Наноскопия с более чем 100 000 «пончиков». Nat Methods 10, 737–740, doi:10.1038/nmeth.2556 (2013).
- ↵
Masullo, L. A. et al. Расширенный сбор фотонов позволяет проводить четырехмерную флуоресцентную наноскопию живых систем. Nat Commun 9, 3281, doi: 10.1038/s41467-018-05799-w (2018).
- ↵
Махичич Д., Теста И., Гриффи Дж. и Мэнли С. Стратегии повышения производительности микроскопов сверхвысокого разрешения.
 Схемы объемные фигурки из бисера: красивые объемные фигурки из бисера схемы: 24 тис. зображень знайдено в Яндекс.Зображеннях
Схемы объемные фигурки из бисера: красивые объемные фигурки из бисера схемы: 24 тис. зображень знайдено в Яндекс.Зображеннях

 Nat Methods 8, 353–359, doi:10.1038/nmeth.1583 (2011).
Nat Methods 8, 353–359, doi:10.1038/nmeth.1583 (2011).  doi: 10.1038/nmeth.1734.
doi: 10.1038/nmeth.1734. 
